CNIO: viaje microscópico buscando la esperanza contra el cáncer
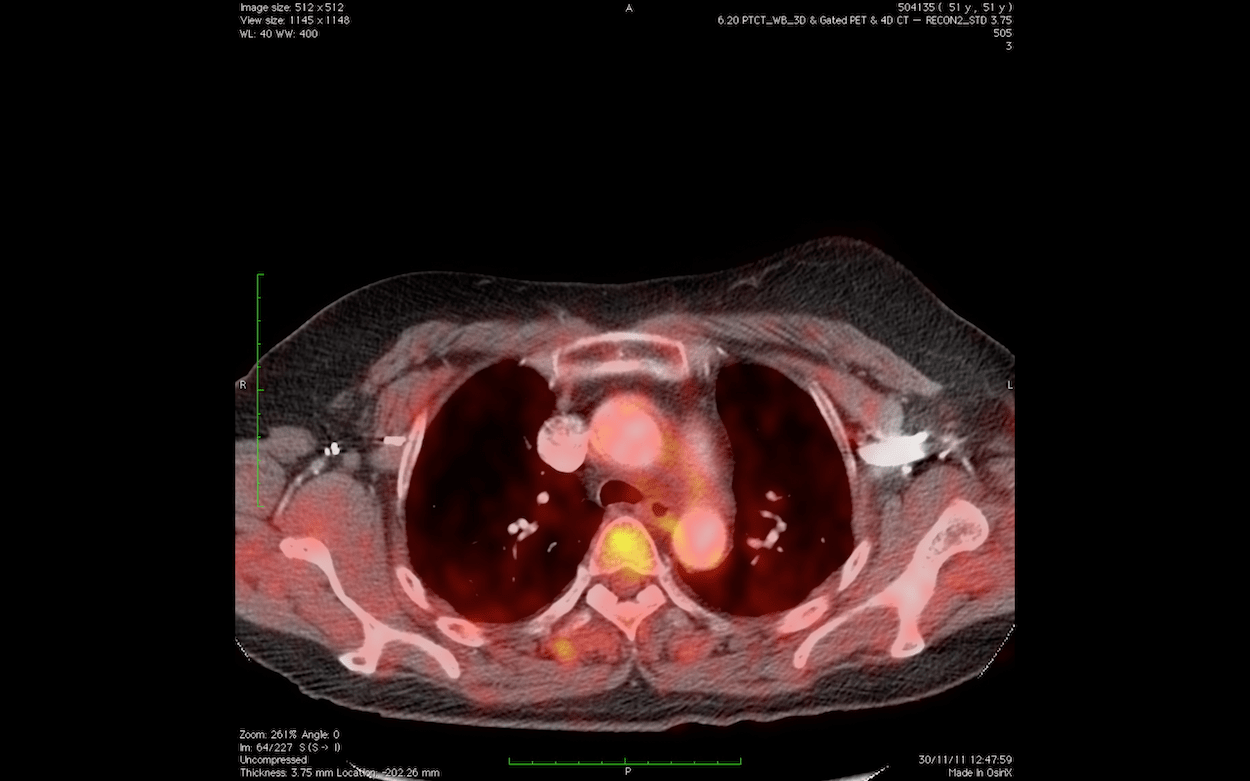
Las sofisticadas técnicas de imagen, cada vez más precisas, empleadas en el CNIO resultan fundamentales para avanzar en la investigación sobre los procesos tumorales. Wholebody converted: combinación de tomografía computarizada y tomografía por emisión de positrones (CT/PET). Imagen: Unidad de Imagen Molecular / CNIO
El Centro Nacional de Investigaciones Oncólogicas (CNIO) es uno de los mejores centros de investigación en cáncer a nivel global. Aquí trabajan más de 500 personas desarrollando proyectos que utilizan sofisticadas técnicas de imagen cada vez más precisas, capaces de llegar hasta el fondo de una estructura celular para observar el comportamiento de componentes minúsculos de las células como proteínas, lípidos o ácidos nucleicos. Una nueva entrega de los ‘sitios de paso’ de la escritora Ana Esteban.
Unos 400 años antes de nuestra era, Empédocles sostenía que la Tierra había dado a luz unas criaturas vivas que no eran más que partes de organismos: “Brazos que vagaban sin hombros y ojos extraviados con necesidad de frentes”. Y esas partes se juntaban formando combinaciones. Quizá esa imagen estrafalaria, casi poética, era, para las mentes que en aquel tiempo trataban de entender la vida, una idea aproximada al modo en que ésta se originaba y desarrollaba. Todo lo demás resultaba misterioso y hermético, porque aún no podían ver lo que sucedía dentro de los cuerpos.
Me acuerdo de las criaturas de Empédocles porque Fernando Peláez, director del Programa de Biotecnología en el Centro Nacional de Investigaciones Oncológicas (CNIO), me está explicando la importancia de la imagen en los avances médicos y científicos. “En la antigüedad no había herramientas para ir más allá de lo que el ojo humano percibe, pero en el siglo XVII hay un punto de inflexión con los primeros microscopios, que permitían ver por ejemplo los microorganismos que había en una gota de agua. Después vendría la teoría celular, descubriendo que todos los seres vivos estamos compuestos de células que se juntan y hacen órganos, los órganos hacen sistemas, los sistemas hacen personas, animales o vegetales, y ese microscopio más o menos mejorado fue la herramienta principal para hacer ciencia hasta por lo menos principios del siglo XX”.
Al otro lado de la ventana del despacho de Peláez las hojas de los árboles aletean como membranas en la brisa caliente de esta mañana de julio. Unos pulcros jardines a los pies de las cuatro grandes torres de Madrid rodean el edificio espejado del CNIO, en cuya entrada, bajo una fuente, hay un gran rótulo que dice: stop cancer. Aquí se investiga para desarrollar nuevas formas de prevenir, diagnosticar y tratar los procesos y alteraciones que provoca esta enfermedad en las células de nuestros cuerpos. Y entre sus principales herramientas figuran las tecnologías de imagen más sofisticadas, capaces de llegar hasta el fondo de una estructura celular para observar el comportamiento de componentes como proteínas, lípidos o ácidos nucleicos.
“La capacidad de progresar en ciencia depende mucho del desarrollo de las tecnologías de imagen,” dice Peláez. “Pero otros avances han sido muy importantes. Un problema que limitaba la tecnología biomédica era la incapacidad de interpretar el ADN. Recuerdo que a finales de los años 70, cuando yo estudiaba, en mi libro de bioquímica aun ponía: ‘El ADN todavía no se puede secuenciar’; no había tecnología suficiente para decodificarlo. En 2003, se publicó el genoma humano completo; ese es uno de los grandes avances de la ciencia biomédica, aunque aún no hemos logrado entender del todo su complejidad. El primer proyecto costó miles de millones de dólares; ahora mismo secuenciar un genoma cuesta unos pocos cientos de euros”.
Mientras que el microscopio clásico funciona con luz transmitida –una luz bajo la muestra que al atravesarla permite ver lo que hay en ella–, la microscopía electrónica emplea electrones, y tiñendo los componentes de una célula se puede observar lo que hay en su estructura. Por ejemplo, las proteínas, de las que me hablarán mucho en los distintos departamentos del CNIO que voy a visitar. “Las técnicas de tinción”, dice Peláez, “son casi tan antiguas como el desarrollo de la química orgánica”. Y aunque le esperan en una reunión, se echa hacia atrás en la silla y me cuenta cómo a mediados del siglo XIX, en plena revolución industrial, la química orgánica da sus primeros pasos usando tintes recién descubiertos en la industria textil, como la anilina, para teñir en microscopía ciertas estructuras celulares, lo que permitió entre otras cosas empezar a clasificar bacterias.
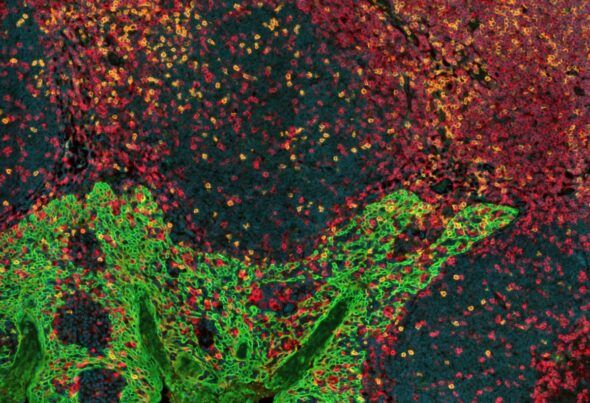
Los glóbulos blancos o linfocitos CD4 (en rojo) y CD8 (en amarillo) se infiltran entre las células del epitelio que recubre las amígdalas (verde). La distribución espacial de las células inmunitarias y su relación con el tumor, así como con otras células inmunitarias, se estudia con microscopía óptica avanzada.
Imagen de Zeiss Axioscan 7, obtenida por las unidades de Microscopía Confocal e Histopatología del CNIO.
Peláez habla de tejidos celulares como si fueran campos de batalla, por donde se mueven mensajeros –el ARN– como piezas en un mapa. Y me explica cómo funciona un espectrómetro de masas, donde puedes hacer volar las proteínas de una célula tan trituradas y con sus membranas tan rotas que forman, dice, “un sopicaldo de tejido”; luego las cortas aún más en pedacitos y se convierten en péptidos, entonces las metes en el espectrómetro que las hace volar vaporizadas de un extremo a otro de un circuito, y por el tiempo que tardan en recorrerlo se calcula la masa exacta de cada pequeño péptido. “Lo que equivale a un péptido de secuencia conocida que se analiza para saber qué tipo de proteínas estaban presentes en la mezcla; es prácticamente magia”, concluye con entusiasmo.
Yo me acuerdo otra vez de los brazos y los ojos extraviados de las teorías de Empédocles, vagando en un espacio tan lejano en el tiempo, y le pregunto por el futuro de todo esto. Preguntar por el futuro en el campo de la investigación contra el cáncer contiene la dosis justa de un lógico anhelo. “Se están desarrollando herramientas que permitirán ver a la vez muchos marcadores distintos; son las nuevas ramas por donde irá la ciencia y será apasionante; combina esto con las herramientas de la IA para manejar la ingente cantidad de datos que esto proporcionará y por ahí van a ir los tiros”.
Tejidos transparentes, órganos encendidos
Casi resulta amable, por reconocible, la imagen en negativo del interior de un cuerpo en uno de los monitores que maneja Francisca Mulero, jefa de la Unidad de Imagen Molecular, donde combinan diferentes técnicas (PET-CT, imagen óptica-TC y ecografía) para detectar con alta resolución cambios fisiopatológicos en las fases tempranas de la enfermedad. “Hacemos investigación, no diagnóstico”, me explica Mulero. “Nuestro trabajo consiste en realizar ensayos clínicos y crear herramientas eficaces que analicen la evolución de los tumores o ver si los tratamientos están funcionando. Manejamos una imagen del cuerpo en vivo y no invasiva, como supondría extraer una muestra de tejido para biopsiar. Para nosotros los tejidos son transparentes; yo puedo ver con estas máquinas lo que está pasando en el cerebro, en los riñones, el hígado, el páncreas…”. En los monitores de Mulero surgen secciones encendidas de órganos que parecen arder con un fuego propio. “Esto que te enseño es un pulmón”, dice. “Sabemos que el tumor consume mucha glucosa y crece, así que le metemos glucosa marcada con un isótopo y la seguimos a lo largo del cuerpo, para saber dónde hay tumores y cuáles son malignos; nuestra ventaja es que vemos el cuerpo entero”.
En la pared de su despacho cuelgan las portadas de prestigiosas revistas científicas ilustradas con sus imágenes, en las que han publicado artículos. “Para mí es un sueño trabajar con estos equipos, porque soy médica y la microscopía electrónica te permite ver por ejemplo proteínas; es fascinante. También vemos cómo se soluciona todo, o cuándo un tratamiento marcha, y eso nos ilusiona”. Recorremos la planta observando algunos equipos como una secuenciadora: una mole alta y plateada como una nave con una pantalla irisada que se llama NovaSeq X-Plus-Illumina. Aquí en el sótano los suelos son de vinilo rojo, pero pienso que deberían ser verdes, como la esperanza.
Células fluorescentes
Los tumores no deberían sobrevivir. Lo dice Isabel Peset, jefa de la Unidad de Microscopía Confocal, mientras observamos en un monitor una masa multicolor de luces flotando en un espacio oscuro, como una hermosa constelación. “Nuestro organismo está hecho para sobrevivir y el tumor no es una infección contra la que el cuerpo tiene que luchar, sino que es parte de nosotros, es capaz de fabricar sus propios vasos sanguíneos para que lleguen los nutrientes y el oxígeno que necesita”.
Y me explica que en un cáncer las células están constantemente multiplicándose con errores, cuando en condiciones normales las defectuosas morirían. Aquí pueden ver la célula y lo que hay dentro de ella con una resolución muy alta y en tres dimensiones, introduciendo la fluorescencia por modificación genética. “La microscopía confocal se diferencia porque utiliza iluminación láser, de manera que el haz de luz pasa por la muestra y hace lo que se llama sección óptica para ver los diferentes planos que luego se reconstruyen en imagen tridimensional; los colores permiten ver hasta siete marcadores distintos en la célula, y eso es muchísima información. Podemos observar estructuras vivas muy dinámicas, que están constantemente creciendo y decreciendo; esto ha revolucionado la biología celular porque nos enseña los procesos para entender qué está pasando y cómo”.
Esta unidad del CNIO funciona como un laboratorio tecnológico donde desarrollan metodología de apoyo a las investigaciones, diseñando experimentos con microscopía de fluorescencia y enseñando a los investigadores a utilizarla. “Las tecnologías van rapidísimo y nosotros las introducimos e implementamos, para lo que debemos estar al día y tener conocimientos muy especializados”, dice Peset.
En la penumbra de una sala, dos de estos investigadores están observando en los monitores el sistema inmune en un tejido de amígdala: los anticuerpos en color rojo, las proteínas en amarillo, que parecen un bosque impenetrable contemplado desde arriba. “Cada tipo de imagen te contesta unas preguntas diferentes. Por eso examinar los tumores es tan importante: te hace entender las mutaciones, los procesos de resistencia o el deterioro por envejecimiento. Aquí en el centro trabajamos con células tumorales en cultivo y también con tejido animal y humano; es muy importante concienciar acerca de las donaciones, que son esenciales para la investigación”. Y observamos, fosforeciendo en la pantalla, una proteína en la punta de un túbulo, viva y creciendo rápidamente. A veces lo que se mueve en nuestro interior, pienso, sigue su propia estrategia: células inmunes que buscan al tumor y consiguen acercarse para atacarlo; células traidoras que se pasan al otro lado, con el enemigo.
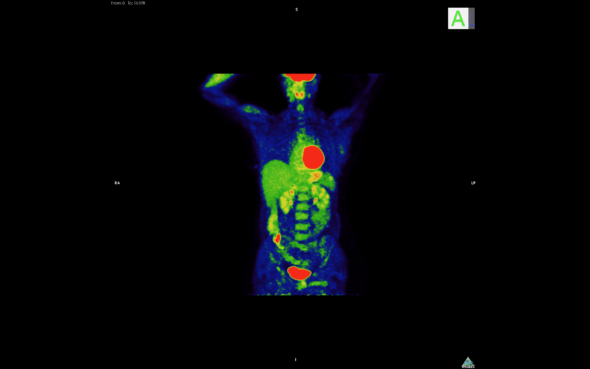
Renderización de tomografía por emisión de positrones (PET). Las zonas rojas corresponden a tumores / metástasis. Imagen: Unidad de Imagen Molecular / CNIO.
Un viaje al fondo de las proteínas
La sala donde me recibe Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en Respuesta a Daños en el DNA, tiene sus ventanales al pie del campus. Aquí es donde, dice, viene a pensar. El nombre del departamento es algo complejo, pero enseguida me aclara que trabajan para determinar y entender la estructura de nuestras proteínas y detectar los problemas en su funcionamiento. Y para ello desarrollan procesos y herramientas de microscopía electrónica que se pueden acercar aún más, hasta desvelar la estructura de proteínas. Hasta su mismo corazón.
“Los tratamientos que se administran a un paciente”, me explica Llorca, “son moléculas en un compuesto químico que tienen que adaptarse a una estructura o introducirse en el punto donde algo está fallando en la célula. El proceso es complejo y hasta hace apenas unos años no se había conseguido seguir el movimiento de una sola molécula y corregir su trayectoria para verla con suficiente nitidez”.
Hace apenas unos años, recuerdo de pronto, los microscopios y las cámaras usaban carrete fotográfico que luego había que revelar en laboratorio. “Ahora se han hecho cosas que antes no se podían hacer”, continúa, “y nosotros aquí hemos contribuido a ello: maquinarias que reparan los daños en el ADN, observar cómo se forman los microtúbulos del citoesqueleto en la célula cuando se está dividiendo; es alucinante cómo ahora podemos ver con resolución atómica una proteína que se mueve de una zona a otra, reparando daños… Esa información nos permite, por ejemplo, buscar compuestos que inhiban ciertos procesos que cursan los tumores. Y todo se está acelerando un montón, estamos trabajando con cosas que han salido hace cinco meses, son procesos que van a revolucionar el potencial curativo”.
En un monitor observamos la estructura de una proteína: manojos de microtúbulos dentados que parecen coronas de corales blancos. Al otro lado de la cristalera, como en una película, dos chicas y un chico con mochila cruzan el camino bajo los árboles. Seguramente son investigadores del centro o becarios que un día, observando el latido de un tejido minúsculo, realizarán sus primeros descubrimientos. Y eso, pienso de pronto, debe de ser algo parecido a cuando encuentras la palabra exacta con la que cerrar un verso; la línea con la que terminas de engarzar tu poema. “Hay una parte de la biología estructural que tiene mucha belleza”, dice Llorca. “Es cuando ves por primera vez cómo es una proteína y su estructura; es algo que muy poca gente ha mirado. La biología funciona muchas veces por hipótesis, pero todo esto tiene la gratificación visual: las cosas están ahí y quizá tú las miras antes que nadie”.
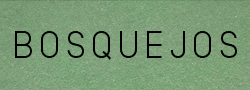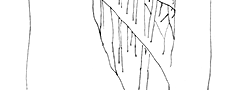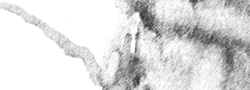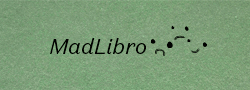







No hay comentarios